Synergistische Hemmung der Replikation von SARS-CoV-2 durch Pyrimidinanaloga und Inhibitoren der Pyrimidinsynthese
Projektleiter: Prof. Dr. med. Matthias Dobbelstein
Schlüsselbereich
- Antivirale Strategien: Wirk- und Impfstoffe, Antikörper
Wer war beteiligt?
- Prof. Dr. med. Matthias Dobbelstein (Projektleiter, UMG)
- Prof. Dr. Maren von Köckritz-Blickwede (TiHo)
- Prof. Dr. Asisa Volz (TiHo)
Was war das Ziel?
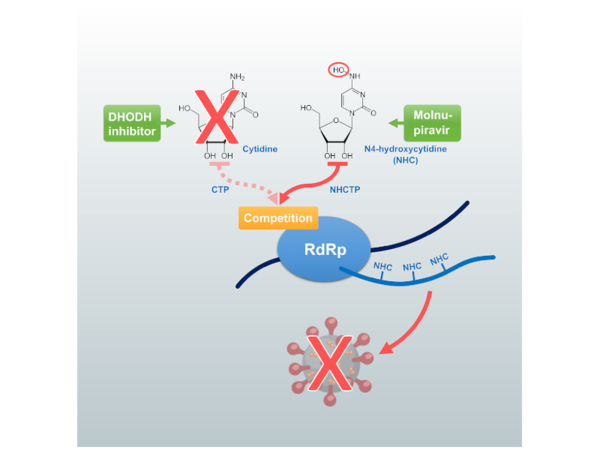
Wir evaluieren die Kombination zweier pharmakologischer Strategien gegen die Vermehrung von SARS-CoV-2. Einerseits behandeln wir mit Molnupiravir, einem Cytidin-Analogon, das fälschlich in die Virus-RNA eingebaut wird. Andererseits hindern wir die Zellen an der Synthese von eigenen Pyrimidinbasen durch Inhibition des Enzyms DHODH. Die synergistische Wirkung dieser beiden Ansätze wird in Zell- und Tiermodellen getestet, um so einen Behandlungsansatz gegen COVID-19 zu entwickeln.
Das wurde erreicht:
Im Projekt wurde untersucht, wie sich antivirale Pyrimidin-Analoga mit Inhibitoren der zellulären Pyrimidinsynthese kombinieren lassen, um die Replikation von SARS-CoV-2 und anderen RNA-Viren besonders wirksam zu hemmen. Ausgangspunkt war die Beobachtung, dass N4-Hydroxycytidin (NHC), der aktive Wirkstoff von Molnupiravir, zum Einbau fehlerhaft paarender Nukleotide in die virale RNA führt und dadurch eine „error catastrophe“ auslöst. Gleichzeitig reduzieren Hemmstoffe der Pyrimidinbiosynthese – etwa DHODH- oder CTPS-Inhibitoren – die Verfügbarkeit natürlicher Nukleotide, die Viren für die Genomreplikation benötigen. Die zentrale Idee des Projekts war es daher, beide Wirkmechanismen zu kombinieren, um die Effektivität antiviraler Nukleosidanaloga zu steigern.
Tatsächlich konnten in Zellkulturen, in humanen Lungenorganoiden und z. T. auch in Tiermodellen ausgeprägte Synergien zwischen Molnupiravir bzw. NHC und DHODH-Inhibitoren gezeigt werden. Konzentrationen, die einzeln kaum antiviral wirkten, führten in Kombination zu einer drastischen Reduktion der Viruslast. Dieses Prinzip ließ sich auch auf andere Nukleosidanaloga wie 4'-Fluorouridin übertragen, das in Verbindung mit DHODH-Hemmern gegen eine Reihe unterschiedlicher RNA-Viren – darunter SARS-CoV-2, Influenza-A-Viren, Henipaviren und Ebolaviren – deutlich stärker wirkte.
Darüber hinaus zeigte sich, dass nicht nur DHODH-, sondern auch CTPS-Inhibitoren eine deutliche Verstärkung der NHC-Wirkung bewirken können. In Zellkulturen ließ sich die Replikation verschiedener SARS-CoV-2-Varianten und Influenza-Subtypen fast vollständig unterdrücken. Ein unerwartetes Ergebnis ergab sich jedoch im SARS-CoV-2-Hamstermodell: Während CTPS-Inhibitoren allein dort eine deutliche antivirale Wirkung zeigten, führte die Kombination mit Molnupiravir nicht zu einer zusätzlichen Verbesserung, sondern schwächte die positive Wirkung sogar ab. Dieses abweichende In-vivo-Verhalten markiert eine der wichtigsten überraschenden Erkenntnisse des Projekts.
Ein weiterer wichtiger Befund betrifft die Mutagenese durch NHC. Da Molnupiravir die Virusevolution beschleunigen kann, wurde untersucht, ob in vitro Resistenzvarianten entstehen, die die Wirkung therapeutischer Antikörper umgehen. Tatsächlich führte die Behandlung mit NHC zur raschen Selektion von Escape-Mutationen im Spike-Protein. Dies legt nahe, dass die Therapie mit Molnupiravir auch zur Entstehung neuer Virusmutanten in Patienten führen könnte.
Auf der Grundlage NHC-vermittelter Mutagenese wurde eine Methode entwickelt, mit der sich durch Selektion in Zellkulturen Escape-Mutanten der Viren für verschiedene therapeutische Antikörper identifizieren und deren Binderegionen kartieren lassen. Diese Vorgehensweise ermöglicht eine vorausschauende Bewertung der Wirksamkeit von Antikörpern gegenüber zukünftigen Virusvarianten.
Insgesamt zeigen die Projektergebnisse, dass Pyrimidin-Analoga in Verbindung mit Inhibitoren der Pyrimidinsynthese ein vielversprechender Ansatz für breit wirksame antivirale Therapien sind, gleichzeitig aber sorgfältig auf mögliche Resistenzentwicklung und auf ihre Kompatibilität in vivo geprüft werden müssen. Die Kombination aus therapeutischem Potenzial, neu gewonnenen mechanistischen Einsichten und methodischer Weiterentwicklung trägt bei zur Weiterentwicklung antiviraler Strategien gegen aktuelle und zukünftige Epidemien.
Publikationen
- Inhibitors of dihydroorotate dehydrogenase cooperate with Molnupiravir and N4-hydroxycytidine to suppress SARS-CoV-2 replication. Kim M. Stegmann , Antje Dickmanns , Natalie Heinen, Claudia Blaurock, Tim Karrasch , Angele Breithaupt, Robert Klopfleisch, Nadja Uhlig, Valentina Eberlein, Leila Issmail, Simon T. Herrmann, Amelie Schreieck, Evelyn Peelen, Hella Kohlhof, Balal Sadeghi, Alexander Riek, John R. Speakman, Uwe Groß , Dirk Görlich, Daniel Vitt, Thorsten Müller, Thomas Grunwald, Stephanie Pfaender, Anne Balkema-Buschmann, and Matthias Dobbelstein. IScience, 104293. https://doi.org/https://doi.org/10.1016/j.isci.2022.104293
- Multiple redox switches of the SARS-CoV-2 main protease in vitro provide opportunities for drug design. Lisa-Marie Funk, Gereon Poschmann, Fabian Rabe von Pappenheim, Ashwin Chari, Kim M Stegmann, Antje Dickmanns, Marie Wensien, Nora Eulig, Elham Paknia, Gabi Heyne, Elke Penka, Arwen R Pearson, Carsten Berndt, Tobias Fritz, Sophia Bazzi, Jon Uranga, Ricardo A Mata, Matthias Dobbelstein, Rolf Hilgenfeld, Ute Curth, Kai Tittmann. Nature Communications 2024, 15:1, 15(1), 1–18, https://doi.org/10.1038/s41467-023-44621-0
- Evaluation of N4-hydroxycytidine incorporation into nucleic acids of SARS-CoV-2-infected host cells by direct measurement with liquid chromatography-mass spectrometry. Krzysztof Urbanowicz, Mikolaj Opielka, Kim M Stegmann, Antje Dickmanns, Matthias Dobbelstein, Godefridus J Peters, Ryszard T Smoleński. Nucleosides Nucleotides & Nucleic Acids 2024, https://doi.org/10.1080/15257770.2024.2346550
- N4-hydroxycytidine, the active compound of Molnupiravir, promotes SARS-CoV-2 mutagenesis and escape from a neutralizing nanobody. Zibat, A., Zhang, X., Dickmanns, A., Stegmann, K. M., Dobbelstein, A. W., Alachram, H., Soliwoda, R., Salinas, G., Groß, U., Görlich, D., Kschischo, M., Wollnik, B., & Dobbelstein, M., IScience, 26(10)2023, https://doi.org/10.1016/j.isci.2023.107786
- Identification of Antibody-Resistant SARS-CoV-2 Mutants via N4-Hydroxyuridine Mutagenesis. Priya Kumar, Xiaoxiao Zhang, Rahul Shaha, Maik Kschischo, Matthias Dobbelstein. Antiviral Research 2024, https://doi.org/10.1016/j.antiviral.2024.106006
- Inhibitors of dihydroorotate dehydrogenase synergize with the broad antiviral activity of 4′-fluorouridine. Leon Schrell, Hannah L. Fuchs, Antje Dickmanns, David Scheibner, Judith Olejnik, Adam J. Hume, Wencke Reineking, Theresa Störk, Martin Müller, Annika Graaf-Rau, Sandra Diederich, Stefan Finke, Wolfgang Baumgärtner, Elke Mühlberger, Anne Balkema-Buschmann, Matthias Dobbelstein. bioRxiv 2024, https://doi.org/10.1016/j.antiviral.2024.106046