Meldung von Vorkommnissen nach Medizinprodukte-Anwendermelde und Informationsverordnung (MPAMIV)
Tritt ein mutmaßlich schwerwiegendes Vorkommnis im Sinne der MPAMIV ein, besteht die Pflicht dieses unverzüglich an die zuständige Bundesoberbehörde zu melden.
Bei einem Vorkommnis bzw. dem Verdacht auf ein Vorkommnis, nehmen Sie das Medizinprodukt sofort außer Betrieb und sichern Sie dieses. Beachten Sie dabei, das Medizinprodukt inkl. Zubehör sicherzustellen und in seiner Form/Zusammensetzung (ggf. auch verschmutzt) zu belassen.
Informieren Sie ggf. den für Ihren Bereich zuständigen Medizinproduktebeauftragten um abzustimmen, ob es sich tatsächlich um ein meldepflichtiges Vorkommnis handelt.
Mutmaßlich schwerwiegendes Vorkommnis
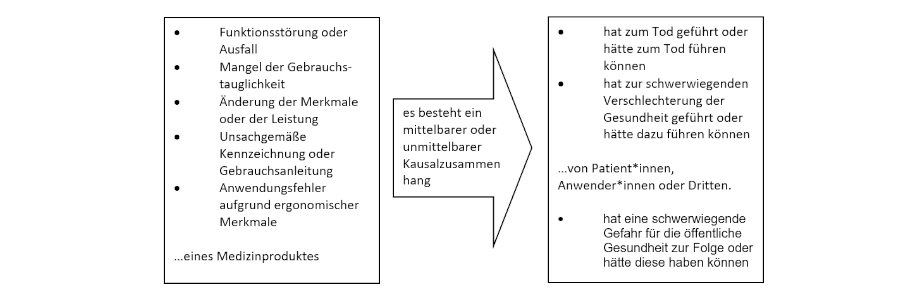
Wichtiger Hinweis: da der Ausfall eines Beatmungs- bzw. Narkosegerätes grundsätzlich immer die Möglichkeit beinhaltet, dass durch das Aussetzen der i. d. R. lebenserhaltenden Beatmung, eine Patientengefährdung eintritt, liegt immer ein meldepflichtiges Vorkommnis vor, sobald der Ausfall des Gerätes durch einen Gerätefehler hervorgerufen wird.
Bei Fragen, wenden Sie sich bitte an vorkommnis.medizinprodukte(at)med.uni-goettingen.de
Meldung
Diese Meldung geht zunächst intern an das Qualitäts- und klinische Risikomanagement. Nach Prüfung, wird das Vorkommnis durch das QRM an die zuständige Bundesoberbehörde (BfArM) und das zuständige Gewerbeaufsichtsamt gemeldet.
Kontakt
Kontaktinformationen
- Telefon: +49 551 3963307
- E-Mail-Adresse: vorkommnis.medizinproduktesicherheit(at)med.uni-goettingen.de